Иммуноглобулины
Антитела (иммуноглобулины, ИГ, Ig) - это белки , относящиеся к подклассу гамма-глобулинов , находящиеся в крови , слюне, молоке и других биологических жидкостях позвоночных животных. Иммуноглобулины синтезируются В-лимфоцитами в ответ на чужеродные вещества определенной структуры - антигены . Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов - например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую функцию и эффекторную (например запуск классической схемы активации комплемента и связывание с клетками), являются важнейшим фактором специфического гуморального иммунитета , состоят из двух лёгких цепей и двух тяжелых цепей. У млекопитающих выделяют пять классов иммуноглобулинов - IgG, IgA, IgM, IgD, IgE, различающиеся между собой по строению и аминокислотному составу тяжелых цепей.
Обычно антитело не разрушает инвагинационный антиген. Образование комплекса антиген-антитело приводит к запуску различных цепочек эффекторных механизмов. Самый простой способ - нейтрализация, которая возникает из-за того, что антитело блокирует определенные сайты на антигене, тем самым делая антиген неэффективным. Нейтрализацию вируса антителом осуществляют путем присоединения антитела к сайту, который вирус использует для док-станции в клетке-хозяине. Агглютинация бактерий антителами является другим эффекторным механизмом.
Предпосылкой для этого является наличие, по меньшей мере, двух сайтов связывания антигена, посредством которых можно сшивать соседние молекулы антигена. Фагоцитотоксические клетки могут убивать бактерии сгущения быстрее, чем люди. Аналогичным механизмом является осаждение. В этом случае сшивание приводит к нерастворимому осаждению, которое глотают фагоциты. Одним из наиболее важных механизмов гуморального иммунного ответа является активация системы комплемента. Антитела, образованные и выделенные из крови иммунизованного животного, называются поликлональными антителами.
История изучения
Самое первое антитело было обнаружено Берингом и Китазато в 1890 году, однако в это время о природе обнаруженного столбнячного антитоксина, кроме его специфичности и его присутствия в сыворотке иммунного животного, ничего определенного сказать было нельзя. Только с 1937 года - исследований Тизелиуса и Кабата, начинается изучение молекулярной природы антител. Авторы использовали метод электрофореза и продемонстрировали увеличение гамма-глобулиновой фракции сыворотки крови иммунизированных животных. Адсорбция сыворотки антигеном, который был взят для иммунизации, снижала количество белка в данной фракции до уровня интактных животных.
Они образованы различными клонами В-клеток, каждый из которых специфичен для конкретного эпитопа антигена, используемого для иммунизации. Каждый нормальный иммунный ответ является поликлональным. Моноклональное означает, что в этом методе все клетки, продуцирующие антитела, являются производными одной клетки. Классификация и свойства иммуноглобулинов человека.
Антитела всегда инициируют свои биологические эффекты путем связывания с антигенами. Антитела, основные молекулы комплекса гистосовместимости и Т-лимфоцитарные рецепторы представляют собой три класса молекул, используемых иммунной системой, для специфического распознавания антигенов. Но из этих трех антител отличаются широким спектром антигенных структур, которые они могут распознать благодаря большой способности различать разные антигены и их большой близости к ним. Антитела продуцируются В-лимфоцитами как форма, связанная с мембраной, действуя как рецепторы В-клеток для распознавания антигенов. Взаимодействие антигена с антителами мембраны В-лимфоцитов представляет собой когнитивную фазу гуморального иммунного ответа. Антитела также секретируются потомством В-лимфоцитов, которые дифференцируются в ответ на антигенную стимуляцию. Эти секретируемые антитела связываются с антигенами и активируют несколько эффекторных функций иммунной системы. Антитела и рецепторы Т-лимфоцитов проявляют три важных свойства: разнородность гетерогенности Происхождение от перестроек генов. Антитела работают как: специфическая часть комплекса В-клеток на уровне мембраны, которая распознает антиген. Циркулирующие молекулы, то есть антитела, секретируемые плазматическими клетками от активации, пролиферации и дифференцировки В-клеток. Эти антитела расположены в: Покрытие определенного внутреннего эпителия. В тканевых жидкостях. Эти циркулирующие антитела являются эффекторами гуморальной ветви специфической иммунной системы. В секреторных жидкостях, таких как слизь и молоко, в которых специфические типы антител специфически транспортируются. Гликопротеины разделяют в соответствии с их растворимостью в альбуминах и глобулинах, которые могут быть разделены электрофорезом. Другим названием антител является термин иммуноглобулин. Антитела обычно очищают из плазмы или других жидкостей с помощью двухстадийной процедуры: очищают их хроматографией: хроматографией на силикагеле. Ионообменная хроматография. Антитела можно разделить на разные классы и подклассы, основанные на различии в физико-химических характеристиках, таких как размер, заряд и растворимость. Большое разнообразие в структуре отвечает за специфичность антигенов, так как каждая разница в аминокислотах может привести к различию в связывании с антигеном. 3 гипервариабельные области легкой цепи и 3 тяжелой цепи соединены в трехмерном пространстве с образованием связующей поверхности для антигена. Эти гипервариабельные области называются областями, определяющими комплементарность. Аминокислотная последовательность константной области С на карбоксильном конце идентична для всех изотипов легкой цепи. У людей антитела с легкими цепями и присутствуют в равных количествах. У мышей антитела, которые содержат легкую цепь , в 10 раз чаще, чем антитела, которые содержат легкую цепь . Все тяжелые цепи, независимо от изотипа антитела, содержат повторяющиеся сегменты длиной приблизительно 110 а.е. Эти сегменты гомологичны друг другу. Постоянная область отличается в каждом изотипе. Секретируемая форма, которая находится в плазме, заканчивается последовательностью, содержащей гидрофильные аа и с нагрузкой. Антитело, которое связано с мембраной В-лимфоцита, имеет другую карбоксильную концевую последовательность, которая включает приблизительно 26 а-гидрофобных без заряда, за которым следует переменное число аа с зарядом, образующим цитоплазматический сегмент. Некоторые могут быть секретированы как димеры. Антитела не являются ферментами и не изменяют ковалентную структуру антигенов.
. Затем пролиферируют и дифференцируют плазматические клетки, продуцируя антитела и клетки памяти.
Строение антител
Общий план строения иммуноглобулинов: 1) Fc; 3) тяжелая цепь; 4) легкая цепь; 5) антиген-связывающийся участок; 6) шарнирный участок
Антитела являются относительно крупными (~150 кДа - IgG) гликопротеидами , имеющими сложное строение. Состоят из двух тяжелых цепей (H-цепи, в свою очередь состоящие из VH, CH1, шарнира, CH2 and CH3 доменов) и из двух лёгких цепей (L-цепей, состоящих из VL и CL доменов). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fc (от fragment crystallizable - фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA) так и в олигомерной форме (димер-секреторный IgA, пентамер - IgM). Всего различают пять типов тяжелых цепей (α-, γ-, δ-, ε-и μ- цепи) и два типа легких цепей (κ-цепь и λ-цепь).
Прежде чем изучать вмешательство иммуноглобулинов в качестве рецептора для В-лимфоцитов, мы собираемся расширить процесс созревания, которым следуют эти клетки, и как перегруппируются гены иммуноглобулина, которые затем будут действовать в качестве рецепторов для этих лимфоцитов.
В-лимфоциты образуются из лимфоидных предшественников, полученных из первичных гемопоэтических клеток, с помощью того, что упоминается в этом процессе, которое происходит в костном мозге, в дополнение к переупорядочению генов иммуноглобулина, выбор репертуара неавтореактивные В-лимфоциты, устраняющие те клоны, которые распознают свои собственные антигены.
Классификация по тяжелым цепям
Различают пять классов (ещё называемых изотипами ) антител, различающихся по строению и функции. Основная структурная единица всех антител состоит из двух одинаковых тяжелых цепей и двух легких цепей, соединенными дисульфидными мостиками. Изотипы антител отличаются по строению тяжелой цепи (IgG содержат две γ-цепи, IgA- две α-цепи, IgM- две μ- цепи, IgD- две δ-цепи, IgE- две ε-цепи), олигомерному строению, местом синтеза.
Генерация репертуара антител
Созревание В-лимфоцитов проходит через три четко определенные стадии. Это поразительно, как организм в дополнение к созданию этого огромного разнообразия рецепторов, которые распознают множественные антигены, необходимо выбрать из всех этих особенностей, порожденных случайным образом, которые не вредны для самого организма. В противном случае антитела, генерируемые реакционной способностью против собственного, будут приводить к разрушению собственных тканей.
Активация В, зависящая от Т-лимфоцитов
Простой рецептор и корецептор обычно называют комплексом рецепторов В-лимфоцитов. Это связано с тем, что для В-лимфоцитов, таких как Т-лимфоциты, требуется, по меньшей мере, два сигнала для их активации. Однако теперь мы знаем, что этот сигнал сам по себе недостаточен для полной активации В-лимфоцитов. Для этого необходим по крайней мере второй сигнал от Т-лимфоцитов и что он опосредуется некоторыми цитокинами, которые будут способствовать распространению и дифференцировке. из них. Для этого требуется адекватное взаимодействие между двумя типами лимфоцитов, В и Т, через молекулы адгезии.
- IgG является основным иммуноглобулином сыворотки здорового человека (составляет 70-75 % всей фракции иммуноглобулинов), наиболее активен во вторичном иммунном ответе и антитоксическом иммунитете. Благодаря малым размерам (коэффициент седиментации 7S, молекулярная масса 146 кДа) является единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивая иммунитет плода и новорожденного.
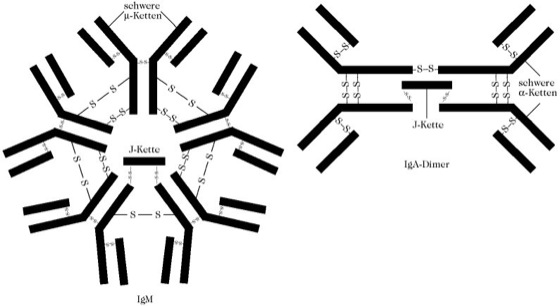
- IgM представляют собой пентамер основной четырехцепочечной единицы, содержащей две μ- цепи. Появляются при первичном иммунном ответе на неизвестный антиген, составляют до 10 % фракции иммуноглобулинов. Являются наиболее крупными иммуноглобулинами (970 кДа).
- IgA сывороточный IgA составляет 15-20 % всей фракции иммуноглобулинов, при этом 80 % молекул IgA представлено в мономерной форме у человека. Секреторный IgA представлен в димерной форме в комплексе секреторным компонентом, содержится в серозно-слизистых секретах (например в слюне , молозиве , молоке , отделяемом слизистой оболочки мочеполовой и респираторной системы).
- IgD составляет менее одного процента фракции иммуноглобулинов плазмы, содержится в основном на мембране некоторых В-лимфоцитов. Функции до конца не выяснены, предположительно является антигенным рецептором для В-лимфоцитов, еще не представлявшихся антигену.
- IgE- связан с мембранами базофиллов и тучных клеток, в свободном виде в плазме почти отсутствует. Связан с аллергическими реакциями.
Специфичность антител
Клонально-селекционная теория имеет в виду то, что каждый лимфоцит синтезирует антитела только одной определенной специфичности. И эти антитела располагаются на поверхности этого лимфоцита в качестве рецепторов.
С другой стороны, мы знаем, что при определенных обстоятельствах В-лимфоциты также могут быть активированы в отсутствие Т-лимфоцитов, и в этом случае, если активация В-клеток не зависит от Т-лимфоцитов. Важно отметить, что части антигена, распознаваемые мембранным иммуноглобулином В-лимфоцитов, могут отличаться от тех, которые согласуют рецепторы Т-лимфоцитов. Например, В-лимфоциты могут взаимодействовать с углеродными антигенами, в то время как Т-лимфоциты будут делать это с пептидами указанного антигена.
Дифференциация В-лимфоцитов
Это означает, что они продолжают распознавать одни и те же антигены, даже если они имеют различный изотип, чем исходные клетки, но с очень значительным увеличением сродства этих антител с их антигенами, прежде всего из-за спонтанных мутаций генов, которые их кодируют. Клетки и молекулы, ответственные за иммунитет, представляют собой иммунную систему, и их коллективный и скоординированный ответ на введение посторонних веществ в организм называется иммунным ответом. Защита от микробов опосредована начальными реакциями врожденного иммунитета более поздними ответами приобретенного иммунитета. Иммунная иммунитет Состоит из механизмов, которые существуют до заражения, которые способны быстро реагировать на микробы и которые в основном реагируют на повторные инфекции. Основные компоненты: Физические и химические барьеры, такие как эпителий и противомикробные вещества, полученные на эпителиальных поверхностях; фагоцитарные клетки и естественные киллерные клетки; белки крови, включая членов системы комплемента и других медиаторов воспаления; и белки, называемые цитокинами, которые регулируют и координируют многие клеточные активности врожденного иммунитета. Приобретенный иммунитет Наиболее высокоразвитые защитные механизмы стимулируются воздействием инфекционных агентов и увеличением величины и защитной способности при каждом последующем воздействии определенного микроба. Поскольку эта форма иммунитета развивается как ответ на инфекцию и адаптируется к ней, она называется приобретенным иммунитетом. Характеристики, определяющие приобретенный иммунитет, являются высокой специфичностью для отдельных макромолекул и способностью «помнить» и более энергично реагировать на повторные воздействия на тот же микроб. Компонентами приобретенного иммунитета являются лимфоциты и их продукты. Посторонние вещества, которые вызывают специфические реакции или являются мишенями этих ответов, называются антигенами. Существует два типа приобретенных иммунных реакций, называемых гуморальным иммунитетом и клеточно-опосредованным иммунитетом. Гуморальный иммунитет опосредуется молекулами крови, которые называются антителами, которые продуцируются В-лимфоцитами. Антитела специфически распознают микробные антигены, нейтрализуют инфекционность микробов и они отмечают микробы для устранения различными эффекторными механизмами. Это главный защитный механизм против внеклеточных микробов и их токсинов. Клеточно-опосредованный иммунитет опосредуется клетками, называемыми Т-лимфоцитами; внутриклеточные микроорганизмы, такие как вирусы и некоторые бактерии, выживают и размножаются в фагоцитах и других клетках-хозяевах, где они недоступны для циркулирующих антител. Защита от таких инфекций является функцией клеточного иммунитета, который способствует уничтожению микробов, находящихся в фагоцитах, или лизиса инфицированных клеток. Клетки иммунной системы Гематопоэз - это процесс образования клеток крови, включая эритроциты, лейкоциты и тромбоциты. После рождения эта гемопоэтическая функция оказывает костный мозг, который содержит клетки-предшественники, вовлеченные во все линии крови. Изначальные гемопоэтические клетки определяются как клетки, которые обладают способностью к самообновлению и также являются плюрипотентными, то есть способными дифференцироваться в несколько клеточных линий или типов клеток. В костном мозге эта первичная клетка, в присутствии стромальных клеток, внеклеточного матрикса и под действием различных факторов роста и цитокинов, будет образовывать двух крупных предшественников, которые являются миелоидами и лимфоидами, которые генерируют все клетки иммунной системы. Миелоидный предшественник вызывает эритроциты, тромбоциты, гранулоциты, тучные клетки и моноциты. Они представляют собой важную клеточную защиту от вторжения микроорганизмов. Нейтрофилы в циркулирующей крови являются сферическими и не фагоцитозу, а становятся амебодами и фагоцитариоми, как только они касаются твердого субстрата, на котором они могут испускать свои псевдоподозы. Захватывающая бактерия окружена псевдоподиями, которые сливаются вокруг нее. Таким образом, бактерия, наконец, занимает вакуоль, ограниченную мембраной, полученной с поверхности нейтрофила. Затем соответствующие гранулы, расположенные поблизости, сливают их мембраны с мембранами фагосом и опустошают их содержимое в них. Затем азурофильные гранулы выводят свои ферменты в фагосому, где происходит гибель и переваривание микроорганизмов. Протонные насосы, расположенные на фагосомной мембране, подкисляют внутреннюю часть этой вакуоли. Кислый рН может убивать бактерии и представляет собой адекватную среду для активности гидролаз лизомоза. Во время фагоцитоза наблюдается резкий и резкий рост потребления кислорода из-за образования перекиси водорода и аниона, который является свободным радикалом, очень реактивным, образованным добавлением электрона к кислороду. Супероксидные анионы и перекись водорода, как энергетические окислители, вероятно, ответственны за гибель фагоцитарных бактерий. Как только микроорганизм умирает, лизосомальные ферменты способствуют его гидролизу в псевдомолекулах, которые диффундируют из вакуоли. Поскольку не все бактерии перевариваются, и не все нейтрофилы выдержали бактериальное действие, может появиться вязкая, обычно желтоватая жидкость, содержащая бактерии, мертвые нейтрофилы, полупереваренный материал и внеклеточная жидкость, называемая гной. Его ядро, в общем, является двудоменным. Цитоплазма эозинофила почти полностью занята конкретными гранулами. Недостаточно развиты эндоплазматический ретикулум, митохондрии и аппарат Гольджи. Эти клетки фагоцитозу и устраняют комплексы антигенов антител, которые появляются в случаях аллергии, таких как бронхиальная астма. Экспериментально установлено, что эозинофил не является антиген фагоцитов и не только его антителом. Однако эозинофильные фагоциты представляют собой комплекс этого антигена с его антителом. Эти гранулоциты притягиваются к зонам аллергического воспаления гистамином, главным образом продуцируемым базофилами и тучными клетками. Имеются данные о том, что эозинофилы продуцируют молекулы, которые инактивируют лейкотриены и гистамин, тем самым модулируя воспаление. Как при паразитозах, так и при аллергии увеличивается количество эозинофилов в крови. Эозинофилы не являются специализированными клетками для фагоцитоза микроорганизмов. Его защитная активность достигается путем выделения содержания его гранул во внеклеточную среду и фагоцитозом комплекса антиген-антитело. Кортикостероиды вызывают немедленное снижение концентрации эозинофилов крови и очагов воспаления. Эти гормоны препятствуют прохождению эозинофилов из костного мозга, где они продуцируются, в систему кровообращения. Они высвобождают свои гранулы во внеклеточную среду под действием тех же раздражителей, которые способствуют вытеснению гранул из тучных клеток. Однако, несмотря на сходство, базофилы и тучные клетки не являются разными аспектами одного и того же типа клеток, поскольку они происходят из разных предшественников. Т-лимфоциты, полученные из клеток, зависят от тимуса для его развития и, следовательно, Т-зависимого ТИМ. Функционально лимфоциты разделяются на Т-хелперные лимфоциты, Т-лимфоциты, цитотоксические Т-лимфоциты и Т-лимфоциты. Каждый из них имеет характерные рецепторы, которые идентифицируются по иммунологическим методам и имеют определенные функции. Эта клетка является самым важным посланником иммунной системы. Он посылает сообщения о нападении на различные лейкоциты для проведения иммунной войны против злоумышленника. Т-хелперный лимфоцит - это клетка, которая взаимодействует с макрофагами, распознавая представленный ей эпитоп. Супрессорные Т-лимфоциты представляют собой лимфоциты, которые имеют функцию модулирования иммунного ответа путем его ингибирования. Мало что известно об этой клетке, но известно, что она действует, инактивируя цитотоксические Т-лимфоциты и помощники, ограничивая их действие на организм в иммунной реакции. Известно, что Т-хелперный лимфоцит активирует Т-супрессорный лимфоцит, который будет контролировать активность этих Т-хелперных лимфоцитов, не позволяя им чрезмерно осуществлять свою деятельность. Т-супрессорные лимфоциты также участвуют в так называемой иммунной толерантности, которая является механизмом, с помощью которого иммунная система использует для предотвращения лейкоцитов от нападения на собственные клетки организма. Поэтому, если есть недостаток в продуцировании или активации супрессорных Т-лимфоцитов, может быть аутоиммунная атака на организм. Он производит перфорины и другие белки, которые убивают чужеродные клетки, инфицированные вирусом клетки и некоторые раковые клетки. Они представляют собой крупные ядра, которые имеют прочный эндоплазматический ретикулум и комплекс Гольджи, чрезвычайно развитый в их цитоплазме, и специалисты по синтезу гаммаглобулинов при активации. Но в покое эти органеллы не развиты. В-лимфоциты имеют свою собственную функцию - продуцирование антител против данного агрессора. Этот иммуноглобулин входит в контакт с антигеном, когда он представлен ему прямо или косвенно макрофагами. Этот комплекс делает несколько модификаций в клетке, целью которых является индуцирование продуцирования иммуноглобулинов. Отдыхающие В-лимфоциты не продуцируют иммуноглобулины, но при стимуляции интерлейкаминами они будут подвергаться клональному расширению и стать активной клеткой, называемой плазмоцитом. Они активно выделяют специфические антитела в гуморальном иммунном ответе. Они лизируют опухоль или инфицированные вирусом клетки без их экспрессии какого-либо антигена, активирующего специфический иммунный ответ. Этот тип ответа называется неспецифическим иммунным ответом, поскольку нет распознавания эпитопов и образования определенных моноклональных клеток или какой-либо иммунной памяти. Эта функция называется антителозависимой клеточной цитотоксичностью. Интерфероновая гамма, продуцируемая хелперными Т-лимфоцитами, стимулирует слияние лизосом с фагосомой для внутриклеточного расщепления. Эти фагоциты имеют в своих лизосомах несколько гидролитических ферментов. У них нет миелопероксидазы, но она убивает бактерии, высвобождая радикалы, полученные из кислорода, такие как супероксид, гидроксильный радикал и перекись водорода. Они будут окислять клеточную мембрану бактерий и образовывать дисульфидные связи между аминокислотами цистеина различных структурных белков бактерии, что приводит к ее смерти. Однако их эпитопы выводятся на поверхность клетки и представлены Т-лимфоцитам или В-лимфоцитам, что стимулирует всю иммунную систему организма и «вызывает» клетки для атаки. Они фагоцитируют клеточный мусор, мертвые клетки, чужеродные белки, костный каллюс, который образуется при переломе, буйной исцеляющей ткани и т.д. после этой очистки активные фибробласты отправляются на сайт и заполняют пространство коллагеном. Этот цитокин стимулирует хелперные Т-лимфоциты к месту заражения, где они будут представлены эпитопам в макрофагах. Он поступает в гипоталамус и стимулирует производство простагландинов, которые активируют систему повышения температуры. Макрофаги отвечают за моноцитарную фагоцитарную систему, поскольку она происходит от созревания моноцитов, которые поступают через кровь. Они присутствуют во многих органах, обильны в лимфоидных органах на участках, богатых Т-лимфоцитами, а в коже они называются клетками Лангерганса. Они считаются иммуностимулирующими клетками, потому что, помимо представления антигенов Т-клеткам, они способны стимулировать Т-клетки, которые еще не вступили в контакт с каким-либо антигеном. Дендритные клетки переносятся кровью во многие нелимфатические органы, где они находятся, все еще в незрелой форме. Эти незрелые дендритные клетки характеризуются большой способностью захватывать и обрабатывать антигены, но у них мало способности стимулировать Т-клетки. Воспаление индуцирует созревание дендритных клеток, которые затем мигрируют через кровь или лимфу в периферические лимфатические органы, Эта клетка не имеет никакого значения в крови, являясь клеткой самой соединительной ткани. Он участвует в аллергических реакциях, в которых он называет лейкоциты на сайте и создает вазодилатацию. Это основная клетка, ответственная за анафилактический шок. Процесс активации дегрануляции основан на сенсибилизации этих клеток. Это гладкое сокращение мышц важно, когда эта анафилактическая реакция возникает в легких и приводит к бронхоконстрикции. Моноциты крови представляют собой стадию созревания фагоцитарной мононуклеарной клетки, происходящей из костного мозга. Эта клетка переходит в кровь, где она остается всего несколько дней, и через стенку капилляров и венулов проникает в некоторые органы, превращаясь в макрофаги, которые представляют собой более продвинутую фазу в жизни фагоцитарной мононуклеарной клетки. Органы иммунной системы Ткани и органы иммунной системы могут быть классифицированы как первичные и вторичные. Первые являются основными сайтами развития лимфоцитов, а последние обеспечивают среду, в которой лимфоциты могут взаимодействовать друг с другом, с дополнительными клетками и антигенами. Именно в так называемых первичных органах это место, где лимфоциты дифференцируются от плюрипотентных клеток, размножаются и созревают в функциональные клетки, и именно там лимфоциты приобретают свой антигенспецифический репертуар, что позволяет их действие против таких антигенов, с которыми организмы сталкиваются друг с другом в течение жизни. В них происходит выбор клеток для толерантности к аутоантигенам, способность распознавать только чужие антигены. Они представлены у млекопитающих тимусом, где созревают Т-клетки, а также печенью и костным мозгом, в которых созревают В-клетки. Печень является местом созревания только во время жизни плода. Так называемые вторичные органы включают селезенку, лимфатические узлы, пятна Пейера, костный мозг и миндалины. Клетки, присутствующие в этих вторичных тканях, возникли в первичных тканях, мигрировали по кровообращению и достигли таких тканей. Введение Исторически, иммунитет означает защиту от инфекционных заболеваний. . Общей чертой этих сущностей является пролиферация клона В-клеток, который синтезирует и секретирует один, гомогенный иммуноглобулин или его фрагменты.
Как показывают опыты, все поверхностные иммуноглобулины клетки имеют одинаковый идиотип: когда растворимый антиген , похожий на полимеризованный флагеллин , связывается со специфической клеткой, то все иммуноглобулины клеточной поверхности связываются с данным антигеном и они имеют одинаковую специфичность то есть одинаковый идиотип.
Антиген связывается с рецепторами, затем избирательно активирует клетку с образованием большого количества антител. И так как клетка синтезирует антитела только одной специфичности, то эта специфичность должна совпадать со специфичностью начального поверхностного рецептора.
Специфичность взаимодействия антител с антигенами не абсолютна, они могут в разной степени перекрестно реагировать с другими антигенами. Антисыворотка, полученная к одному антигену, может реагировать с родственным антигеном, несущим одну или несколько одинаковых или похожих детерминант . Поэтому каждое антитело может реагировать не только с антигеном, который вызвал его образование, но и с другими, иногда совершенно неродственными молекулами. Специфичность антител определяется аминокислотной последовательностью вариабельных областей Ig.
Клонально-селеционная теория :
- Антитела и лимфоциты с нужной специфичностью уже существуют в организме до первого контакта с антигеном.
- Лимфоциты, которые участвуют в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. У B-лимфоцитов рецепторы- молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют.
- Любой лимфоцит несет на своей поверхности рецепторы только одной специфичности.
- Лимфоциты, имеющие антиген , проходят стадию пролиферации и формируют большой клон плазматических клеток. Плазматические клетки синтезируют антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины , которые выделяются другими клетками. Лимфоциты могут сами выделять цитокины.
Вариабельность антител
Антитела являются чрезвычайно вариабельными (в организме одного человека может существовать до 0,1 миллиарда вариантов антител). Все разнообразие антител проистекает из вариабельности как тяжелых цепей, так и легких цепей. У антител, вырабатываемых тем или иным организмом в ответ на те или иные антигены, выделяют:
- Изотипическая вариабельность - проявляется в наличии классов антител(изотипов), различающихся по строению тяжелых цепей и олигомерностью, вырабатываемых всеми организмами данного вида;
- Аллотипическая вариабельность - проявляется на индивидуальном уровне в пределах данного вида в виде вариабельности аллелей иммуноглобулинов- является генетически детерминированым отличием данного организма от другого;
- Идиотипическая вариабельность - проявляется в различии аминокислотного состава антиген-связывающего участка. Это касается вариабельных и гипервариабельных доменов тяжелой и легкой цепи, непосредственно контактирующих с антигеном.
Контроль пролиферации
Наиболее эффективный контролирующий механизм заключается в том, что продукт реакции одновременно служит ее ингибитором. Этот тип отрицательной обратной связи имеет место при образовании антител. Действие антител нельзя объяснить просто нейтрализацией антигена, потому что целые молекулы IgG подавляют синтез антител намного эффективнее, чем F(ab")2 -фрагменты. Предполагают, что блокада продуктивной фазы T-зависимого B-клеточного ответа возникает в результате образования перекрестных связей между антигеном, IgG и Fc - рецепторами на поверхности B-клеток. Инъекция IgM , усиливает иммунный ответ.Так как антитела именно этого изотипа появляются первыми после введения антигена, то на ранней стадии иммунного ответа им приписывается усиливающая роль.
- А. Ройт, Дж. Брюсстофф, Д. Мейл. Иммунология- М.: Мир, 2000 - ISBN 5-03-003362-9
- Иммунология в 3 томах / Под. ред. У. Пола.- М.:Мир, 1988
- В. Г. Галактионов. Иммунология- М.: Изд. МГУ, 1998 - ISBN 5-211-03717-0
См. также
- Абзимы - каталитически активные антитела
| Иммунная система / Иммунология | |
|---|---|
| Системы | Адаптивная иммунная система и Врожденная иммунная система · Гуморальная иммунная система и Клеточная иммунная система · Система комплемента (Анафилотоксины) · Intrinsic immunity |
| Антигены и антитела | Антиген (Суперантиген, Аллерген) ·
Гаптен ·
Эпитоп (Линейный эпитоп, Конформационный эпитоп) Антитело (Моноклональные антитела , Поликлональные антитела, Аутоантитела) · Polyclonal B cell response · Аллотипы антител · Изотипы антител · Идиотипы антител Иммунный комплекс |
| Клетки иммунной системы Лейкоциты |
|
Вопросы к занятию.
1. Общая характеристика клеток, синтезирующих иммуноглобулины.
2. Строение мономера иммуноглобулинов.
3. Структурно-функциональные особенности иммуноглобулинов различных классов.
4. Понятия валентности, аффинности,авидности антитела.
Плазматические клетки. Еще находясь на стадии плазмобластов, будущие продуценты антител покидают лимфатические узлы и селезенку. В конечном счете, большинство этих клеток попадает в костный мозг (40–45%) и слизистые оболочки, преимущественно кишечника (33–35%). Во вторичных лимфоидных органах остается меньше 25% антителообразующих клеток (7–8% в селезенке и 15–17% в лимфатических узлах). В слизистых оболочках плазмоциты локализуются в lamina propria и подслизистом слое, в коже - в дерме. Зрелые плазматические клетки полностью утрачивают подвижность, а также способность реагировать практически на все внешние стимулы. Это обусловлено потерей характерных для В-клеток мембранных молекул - иммуноглобулинов и других компонентов BCR, молекул MHC, костимулирующих молекул. Наиболее характерный мембранный маркер плазмоцитов - белок синдикан (CD138), участвующий во взаимодействии плазматических и стромальных клеток.
Плазматические клетки имеют большой размер (20 мкм и более). Для ядра этих клеток характерна периферическая конденсация хроматина. Цитоплазма характеризуется большим объемом, базофилией и сильно развитым аппаратом синтеза белка (разветвленный эндоплазматический ретикулум, рибосомы, аппарат Гольджи). Цитоплазма имеет максимальный объем на стадии незрелой плазматической клетки, которая еще сохраняет способность к делению. Зрелые плазмоциты представляют собой образец высокоспециализированных клеток. До 50% матричной РНК в зрелых плазматических клетках кодирует иммуноглобулин, на долю которого приходится около 30% синтезируемого белка. Каждая плазматическая клетка синтезирует и секретирует антитела одного изотипа, аллотипа, идиотипа и одной специфичности.
Антитела относятся к γ-глобулиновой фракции белков сыворотки крови. На долю γ-глобулинов приходится 15-25 % белкового содержания сыворотки крови, что составляет примерно 10-20 г/л. Поэтому антитела получили название иммуноглобулинов , и их обозначают символом Ig . Следовательно, антитела - это γ-глобулииы , вырабатыва емые в ответ на введение антигена, способ ные специфически связываться с антигеном и участвовать во многих иммунологических реакциях .
Антитела синтезируются В-лимфоцитами и их потомками - плазматическими клетками.
Иммуноглобулины существуют :
в циркулирующей форме,
в виде рецепторных молекул на иммунокомпетентных клетках
миеломных белков.
Циркулирующие антитела подразделяются на сывороточные и секреторные. К антителам могут быть также отнесены белки Бенс-Джонса, которые являются фрагментами молекулы Ig (его легкая цепь) и синтезируются в избытке при миеломной болезни.
Молекулярное строение антител
Иммуноглобулины являются гликопроте идами.
Молекулы Ig, несмотря на их видимое разнообразие, имеют универсальное строение .
две тяжелые цепи
две легкие .
Обозначают их как Н- (от англ. heavy - тяжелый) и L- (от англ. light - легкий) цепи.
Тяжелые и легкие цепи связаны между собой попарно дисульфидными связями (- S - S -).
Между тяжелыми цепями также есть дисульфидная связь. Это так называемый «шар нирный» участок . Такой тип межпептидного соединения придает структуре молекулы динамичность - он позволяет легко менять конформацию в зависимости от окружающих. Шарнирный участок ответствен за взаимодействие с первым компонентом комплемента (С1) и активацию его по классическому пути.
Легкие цепи бывают 2 типов : (каппа и лямбда).
Тяжелых цепей известно 5 типов : (альфа, гамма, мю, эпсилон и дельта), - которые имеют также и внутреннее подразделение.
Домены различаются по постоянству аминокислотного состава. Выделяют С-домены (от англ. constant - постоянный), с неизменной, или постоянной, структурой полипептидной цепи, и V -домены (от англ. variable - изменчивый), с переменной структурой .
В составе легкой цепи есть по одному V- и С-домену, а в тяжелой - один V- и 3-4 С-домена.
Вариабельные домены легкой и тяжелой цепи совместно образуют участок, который специфически связывается с антигеном. Это антигенсвязывающий центр молекулы Ig или паратоп – Fab -фрагмент.
Fc (от англ. «фрагмент кристаллизующийся»)- фрагмент. Он ответствен за связывание с рецепторами на мем бране клеток макроорганизма (Fc -рецепторы) и некоторыми микробными суперантигенами (например, белком А стафилококка).
Помимо вышеописанных, в структуре молекул Ig обнаруживают дополнительные полипептидные цепи. Так, полимерные молекулы IgM и IgA содержат J -пептид (от англ. join - соединяю). Он объединяет отдельные мономеры в единое макромолекулярное образование и обеспечивает превращение полимерного Ig в секреторную форму.
Молекулы секреторных Ig в отличие от сывороточных обладают особым S -пептидом (от англ. secret - секрет). Это так называемый секреторный компонент. Секреторный компонент - продукт деградации рецептора эпителиальной клетки к J-пептиду. Он обеспечивает перенос молекулы Ig через эпителиальную клетку в просвет органа (трансцитоз) и предохраняет ее в секрете слизистых от ферментативного расщепления.
Структурно-функциональные особенности иммуноглобулинов различных классов
В зависимости от особенностей молекулярного строения тяжелой цепи (т. е. наличия изотопических, или групповых антигенных детерминант) различают 5 классов , или изотипов Ig .
а-типа, относят к изотипу А (сокращенно IgA);
IgD обладает δ-цепью,
IgE- ε-цепью,
IgG- γ-цепью
IgM - μ-цепью.
Соответственно особенностям строения подтипов тяжелых цепей различают и подклассы Ig.
В структуре молекул Ig разных классов прослеживается общая закономерность - все они построены из одних и тех же элементов, которые были описаны. Однако для каждого изотипа характерны свои особенности. В частности, IgD , IgE и IgG имеют мономерное строение , IgM - практически всегда является пентамером , а молекула IgA может быть моно-, ди- и тримером.
Иммуноглобулин класса G . Изотип G составляет основную массу Ig сыворотки крови. На его долю приходится 70-80 % всех сывороточных Ig, при этом 50 % содержится в тканевой жидкости. Среднее содержание IgG в сыворотке крови здорового взрослого человека 12 г/л. Этот уровень достигается к 7-10-летнему возрасту. Период полураспада IgG - 21 день.
IgG - мономер, имеет 2 антигенсвязы вающих центра (может одновременно связать 2 молекулы антигена, следовательно, его валентность равна 2), молекулярную массу около 160 кДа и константу седиментации 7S. Различают подтипы Gl , G 2, G 3 и G 4 .
Синтезируется зрелыми В-лимфоцитами (В у) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
Обладает высокой аффинностью .
IgGl и IgG 3 связывают комплемент , причем G3 активнее, чем Gl.
IgG 4, подобно IgE , обладает цитофильностью (тропностью, или сродством, к тучным клеткам и базофилам) и участвует в развитии аллергической реакции I типа. В иммунодиагностических реакциях IgG может проявлять себя как неполное антитело.
Легко проходит через плацентарный барь ер и обеспечивает гуморальный иммунитет новорожденного в первые 3-4 месяца жизни. Способен также выделяться в секрет слизистых, в том числе в молоко путем диффузии.
IgG обеспечивает:
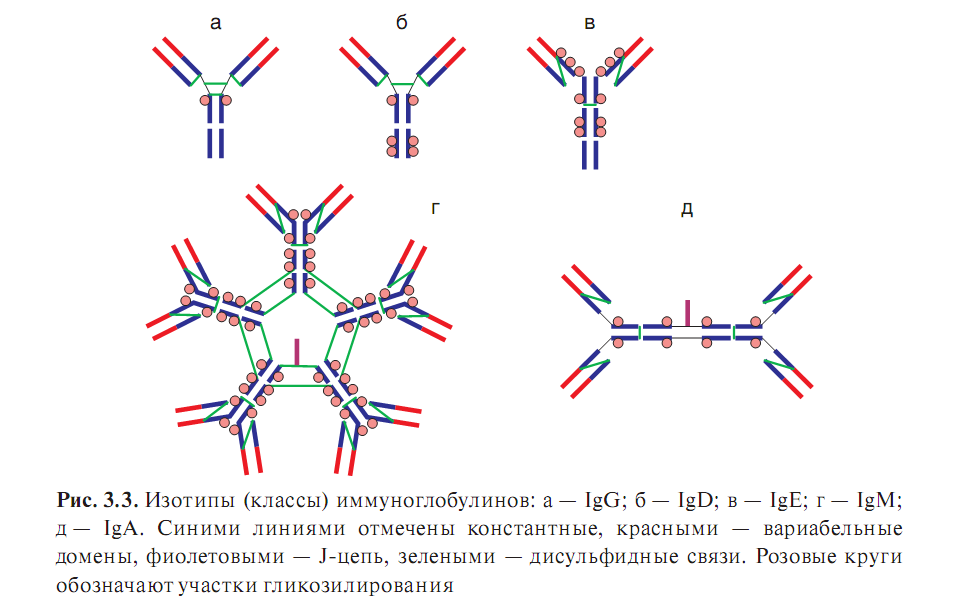
Иммуноглобулин класса М. Наиболее крупная молекула из всех Ig. Это пентамер, который имеет 10 антигенсвязывающих центров, т. е. его валентность равна 10 . Молекулярная масса его около 900 кДа, константа седиментации 19S. Различают подтипы Ml и М2 . .Тяжелые цепи молекулы IgM в отличие от других изотипов построены из 5 доменов. Период полураспада IgM - 5 дней.
На его долю приходится около 5-10 % всех сывороточных Ig. Среднее содержание IgM в сыворотке крови здорового взрослого человека составляет около 1 г/л. Этот уровень у человека достигается уже к 2-4-летнему возрасту.
IgM филогенетически - наиболее древний иммуноглобулин. Синтезируется предшественниками и зрелыми В-лимфоцитами (В ц). Образуется в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного - определяется уже на 20-й неделе внутриутробного развития.
Обладает высокой авидностью , наиболее эффективный активатор комплемента по клас сическому пути . Участвует в формировании сывороточного и секреторного гуморального иммунитета. Являясь полимерной молекулой, содержащей J-цепь, может образовывать секреторную форму и выделяться в секрет слизистых, в том числе в молоко Большая часть нормальных антител и I изоагглютининов относится к IgM.
Не проходит через плаценту. Обнаружение специфических антител изотипа М в сыворотке крови новорожденного указывает на бывшую внутриутробную инфекцию или дефект плаценты.
IgM обеспечивает:
нейтрализацию,
опсонизацию маркирование антигена,
осуществляет запуск комплемент-опосредованного цитолиза
антителозависимой клеточно-опосредованной цитотоксичности.
Иммуноглобулин класса А. Существует в сывороточной и секреторной формах. Около 60 % I всех IgA содержится в секретах слизистых. Сывороточный IgA : На его долю приходится около 10-15 % всех сывороточных Ig. В сыворотке крови здорового взрослого человека содержится около 2,5 г/л IgA, максимум достигается к 10-летнему возрасту. Период полураспада IgA - 6 дней.
IgA - мономер , имеет 2 антигенсвязывающих центра (т. е. 2-валентный), молекулярную массу около 170 кДа и константу седиментации 7S. Различают подтипы А1 и А2 .
Синтезируется зрелыми В-лимфоцитами (В а) и плазматическими клетками. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе.
Обладает высокой аффинностью . Может быть неполным антителом. Не связывает комплемент .
Не проходит через плацентар ный барьер.
IgA обеспечивает :
нейтрализацию,
опсонизацию
маркирование антигена,
осуществляет запуск антителозависимой клеточно-опос-редованной цитотоксичности.
Секреторный IgA : В отличие от сывороточного, секреторный IgA (slgA) существует в полимерной форме в виде ди- или тримера (4- или 6-валентный) и содержит J- и S-nenтиды. Молекулярная масса 350 кДа и выше, константа седиментации 13S и выше.
Синтезируется В а -лимфоцитами и их потомками - плазматическими клетками соответствующей специализации только в пределах слизистых и выделяется в их секреты. Объем продукции может достигать 5 г в сутки. Пул slgA считается самым многочисленным в организме - его количество превышает суммарное содержание IgM и IgG. В сыворотке крови slgA не обнаруживается.
Формирование молекулы slgA происходит при прохождении через эпителиальную клетку, где он присоединяется к секреторному компоненту. На базальной и латеральной поверхности эпителиальная клетка несет рецептор к J-цепи полимерной молекулы Ig (JR). Образующийся после взаимодействия этого рецептора с полимерной молекулой IgA комплекс эндоцитиру-ется клеткой в виде везикулы. Затем везикула переносится к апикальной поверхности эпите-лиоцита, где JR подвергается ферментативному расщеплению. В итоге IgA высвобождается в слизистый секрет просвета органа уже в секреторной форме - оставшийся прикрепленным к молекуле Ig фрагмент JR является S-цепью.
Секреторная форма IgA - основной фактор специфического гуморального местного иммунитета слизистых оболочек желудочно-кишечного тракта, мочеполовой системы и респираторного тракта. Благодаря S-цепи он устойчив к действию протеаз. slgA не активирует комплемент, но эффективно связывается с антигенами и нейтрализует их. Он препятс твует адгезии микробов на эпителиальных клетках и генерализации инфекции в преде лах слизистых.
Иммуноглобулин класса Е. Называют так же реагином . Содержание в сыворотке крови крайне невысоко - примерно 0,00025 г/л. Обнаружение требует применения специальных высокочувствительных методов диагностики. Молекулярная масса - около 190 кДа, константа седиментации - примерно 8S, мономер. На его долю приходится около 0,002 % всех циркулирующих Ig. Этот уровень достигается к 10-15 годам жизни.
Синтезируется зрелыми В-лимфоцитами (В е) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и ЖКТ.
Не связывает комплемент .
Не проходит че рез плацентарный барьер.
Обладает выраженной цитофильностыо - тропностыо к тучным клеткам и базофилам. Участвует в развитии гиперчувствительности немедленного типа - реакция I типа .
Иммуноглобулин класса D . Сведений об Ig данного изотипа не так много. Практически полностью содержится в сыворотке крови в концентрации около 0,03 г/л (около 0,2 % от общего числа циркулирующих Ig). IgD имеет молекулярную массу 160 кДа и константу седиментации 7S, мономер.
Не связывает комплемент. Не проходит через плацентарный барьер. Является рецептором предшественников В-лимфоцитов.
Рецепторные иммуноглобулины. Рецепторные, или мембраные Ig, локализуются на цитоп лазматической мембране В-лимфоцитов. Выполняют функции антигенспецифических рецепторов. Рецепторные Ig имеют те же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Структурное отличие от секретируемых антител заключается в особом, дополнительном М-пептиде , благодаря которому молекула рецепторного Ig фиксируется в цитоплазматической мембране иммунокомпетентной клетки.
Нормальные антитела. В сыворотке крови человека всегда определяется базальный уровень иммуноглобулинов, которые получили название нормальных, или естественных, антител. К нормальным антителам относят изогемагглютинины - антитела различной аффинности и специфичности направленные против эритроцитарных антигенов групп крови (система АВО), а также против бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без явной антигенной стимуляции. С одной стороны, они отражают готовность макроорганизма к иммунному реагированию, а с другой - могут свидетельствовать об отдаленном контакте с антигеном.
Моноклональные антитела. Каждый В-лимфоцит и его потомки, образовавшиеся в результате пролиферации (т. е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных. В природных условиях макроорганизма получить моноклональные антитела практически невозможно. Дело в том, что на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов, незначительно различающихся антигенной специфичностью рецепторов и, естественно, аффинностью. Поэтому в результате иммунизации даже
монодетерминантным антигеном мы всегда получаем поликлональные антитела.
Принципиально получение моноклональных антител выполнимо, если провести предварительную селекцию антителопродуцирую-щих клеток и их клонирование (т. е. выделение отдельных клонов в чистые культуры). Однако задача осложняется тем, что В-лимфоциты, как и другие эукариотические клетки, имеют ограниченную продолжительность жизни и число возможных митотических делений.
Проблема получения моноклональных антител была успешно решена Д. Келлером и Ц. Мильштейном (1975). Авторы получили гибридные клетки путем слияния иммунных В-лимфоцитов с миеломной (опухолевой) клеткой. Полученные гибриды обладали специфическими свойствами антителопро-дуцента и «бессмертием» раковотрансфор-мированной клетки. Такой вид клеток получил название гибридом. Гибридома хорошо размножается в искусственных питательных средах и в организме животных и в неограниченном количестве вырабатывает антитела. В результате дальнейшей селекции были отобраны отдельные клоны гибридных клеток, обладавшие наивысшей продуктивностью и наибольшей аффинностью специфических антител.
Гибридомные моноклональные антитела нашли широкое применение при создании диагностических и лечебных иммунобиологических препаратов.
Полные и неполные антитела.
Среди многообразия Ig выделяют:
неполные антитела.
Деление основано на способности образовывать в реакции агглютинации или преципитации ( in vitro ) хорошо различимую глазом макромолекулярную структуру гигантского иммунного комплекса. Таким свойством обладают полные антитела . К ним относятся полимерные молекулы Ig (изотип М), а также некоторые IgA и IgG.
Неполные антитела лишены такой способности, несмотря на то что они специфически связываются с антигеном. В связи с этим их еще называют непреципитирующими или блокирующими антителами. Причиной этого явления может быть экранирование одного из антигенсвязывающих центров мономерной молекулы Ig, а также недостаточное число или малая доступность антигенных детерминант на молекуле антигена. Выявить неполные антитела можно при помощи реакции Кумбса - путем использования «вторых», ан- тииммуноглобулиновых антител.
Другие виды антител. Помимо вышеприведенных различают тепловые и холодовые ан титела. Первые взаимодействуют с антигеном при температуре +37 °С. Для вторых наибольшая эффективность связывания проявляется в диапазоне +4... -10 °С. Понижение температуры реакционной смеси позволяет в ряде случаев (например, при отсутствии специфического антигена) ограничить низкоаффинные взаимодействия и повысить специфичность реакции.
По способности активировать комплемент (классический путь) антитела подразделяются на комплементсвязывающие (IgM, IgGl и IgG3) и комплементнесвязывающие.
В последние годы открыт вид антител, которые выполняют функции катализаторов биохимических процессов - обладают протеазной или нуклеазной активностью. Это реликтовые свойства антител. Такие антитела получили название абзимы .
Большим достижением молекулярной биологии в области иммунологии, помимо гибридом, явилось получение белков со свойствами антител - это одноцепочечные антитела, бифункциональные антитела и иммунотокси-ны. Они синтезируются живыми биологическими системами. Одноцепочечные антитела представляют собой фрагмент вариабельного домена Ig, который обладает определенной специфичностью и аффинностью и способен к блокирующему действию. Размер такой молекулы очень мал и практически не обладает иммуногенностью. Бифункциональные антитела имеют антигенсвязывающие центры разной специфичности, т. е. направлены к различным антигенным детерминантам. Иммунотоксины представляют собой гибрид молекулы иммуноглобулина и токсина. Они способны направленно доставить молекулу токсина к клетке-мишени, убить ее или нарушить в ней метаболические процессы.
Иммунотоксины и бифункциональные антитела имеют большое будущее. В перспективе их будут использовать для иммунодиагностики, а также профилактики и лечения инфекционных, онкологических, аллергических и других заболеваний.
Механизм взаимодействия антитела с антигеном
В процессе взаимодействия с антигеном принимает участие не вся молекула Ig, а лишь ее ограниченный участок - антигенсвязывающий центр, или паратоп, который локализован в Fab -фрагменте молекулы Ig. Co своей стороны, антитело взаимодействует не со всей молекулой антигена сразу, а лишь с ее антигенной детерминантой.
Антитела отличает специфичность взаимодействия, т. е. способность связываться со строго определенной антигенной детерминантой. Наиболее доступные для взаимодействия эпитопы располагаются на поверхности молекулы антигена.
Связь антигена с антителом осуществляется за счет слабых взаимодействий (ван-дерваальсовы силы, водородные связи, электростатические взаимодействия) в пределах антигенсвязывающего центра. Такая связь отличается неустойчивостью - образовавшийся иммунный комплекс (ИК) может легко диссоциировать на составляющие его компоненты. Поэтому взаимодействие антигена и антитела может быть представлено в виде уравнения:
[АГ] + [ AT ] « [ИК].
Продолжительность существования иммунного комплекса определяется целым рядом факторов. При этом важное значение имеют особенности антитела, антигена и условия, в которых происходит их взаимодействие.
К особенностям антитела следует отнести его аффинность и авидность.
Аффинность - сила специфического взаимодействия антитела с антигеном (или энергия их связи). Эта характеристика зависит от степени стерического, или пространственного, соответствия (комплементарности) структуры антигенсвязывающего центра и антигенной детерминанты. Чем выше их комплементарность, т. е. чем больше они подходят друг другу, тем больше образуется межмолекулярных связей и тем выше будет устойчивость и продолжительность жизни образовавшегося иммунного комплекса. Структурные несоответствия антигенсвязывающего центра и антигенной детерминанты существенно снижают число образующихся связей и прочность взаимодействия антитела с антигеном. Иммунный комплекс, образованный низкоаффинными антителами, чрезвычайно неустойчив, имеет малую продолжительность существования и быстро распадается на исходные компоненты.
Установлено, что в условиях макроорганизма с одной и той же антигенной детерминантой способны одновременно прореагировать и образовать иммунный комплекс около 100 различных клонов антител. Все они будут отличаться структурой антигенсвязывающего центра и аффинностью.
Аффинность антител существенно меняется в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов В-лимфоцитов. Наименее аффинными считаются нормальные антитела. По расчетам, общее число различных антигенспецифических клонов В-лимфоцитов достигает 10 6 -10 7 .
Под термином «авидность» понимают прочность связывания антитела и антигена. Эта характеристика определяется аффинностью Ig и числом антигенсвязывающих центров. При равной степени аффинности наибольшей авид-ностью обладают антитела класса М, так как они имеют 10 антигенсвязывающих центров.
Особенности антигена также влияют на эффективность его взаимодействия с антителом. Так, важное значение имеют стерическая (пространственная) доступность антигенной детерминанты для антигенсвязывающего центра молекулы Ig и число эпитопов в составе молекулы антигена.
Эффективность взаимодействия антитела с антигеном существенно зависит от усло вий, в которых происходит реакция, и прежде всего от рН среды, осмотической плотности, солевого состава и температуры среды. Оптимальными для реакции антиген-антитело являются физиологические условия внутренней среды макроорганизма: близкая к нейтральной реакция среды, присутствие фосфат-, карбонат-, хлорид- и ацетат-ионов, осмолярность физиологического раствора (концентрация раствора 0,15 М), а также температура (36-37 °С).
Свойства антител
Благодаря уникальной способности специфически связываться с антигенными детерминантами, антитела выполняют в организме ряд важнейших функций, как форма иммунного реагирования и фактор регуляции иммунореактивности. При этом необходимо дифференцировать эффекты специфического, высокоаффинного взаимодействия и неспецифического, низкоаффинного.
В результате специфического взаимодейс твия эпитопа молекулы антигена с паратопом молекулы антитела может образоваться устойчивый иммунный комплекс с продолжительностью жизни, достаточной для про явления эффекторных свойств молекулы им муноглобулина.
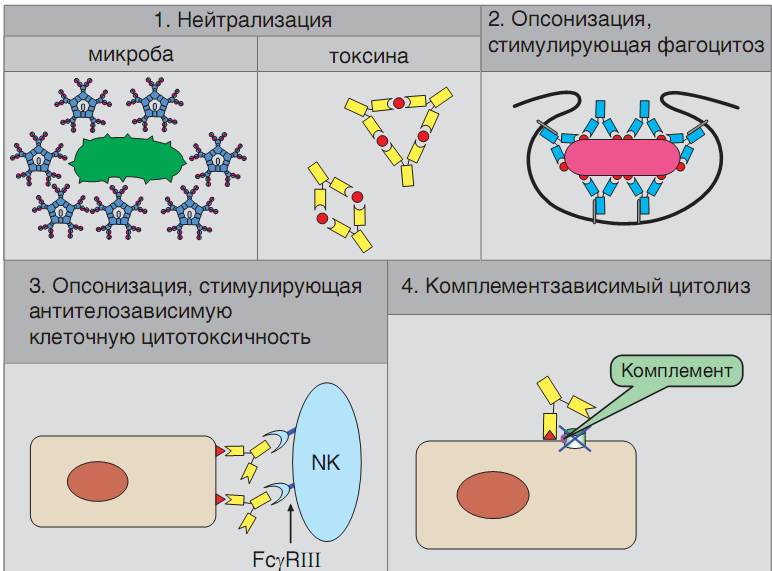
Эффекторная функция антител
Это означает, что благодаря своим уникальным способностям антитела могут оказывать прямое или опосредованное воздействие на молекулы антигена:
нейтрализовать или маркировать антиген,
вызвать его деструкцию или элиминацию.
К прямым эффектам антител относится нейтрализация. Она достигается путем связывания и блокирования паратопом иммуноглобулина активного центра биологически активной молекулы, например, токсина, рецептора, лекарственного препарата и пр. Эффект имеет обратимый характер в случае распада иммунного комплекса и требует подключения других механизмов иммунной защиты (фагоцитоз, лизис). На принципе нейтрализации основан механизм действия антитоксических, противовирусных и многих других лечебных иммунных сывороток.
Энзиматическое действие антител также относится к прямым эффектам. Они связаны со стабильной областью V-домена L-цепи. Благодаря реликтовой протеазной или нуклеазной, иммуноглобулины способны вызывать деструкцию молекулы антигена (например, расщепление отдельных пептидов или ДНК).
В большинстве случаев взаимодействие антител с антигеном в организме не влечет за собой непосредственно нейтрализацию биологического действия последнего, а также его разрушение или утилизацию. Прочно связываясь с эпиопом, антитела «маркируют» молекулу антигена - обозначают его как мишень для факторов элиминации или деструкции (фагоцитоз, лизис).